Stężenie roztworu to stosunek ilości substancji rozpuszczonej dookreślonej ilości (objętości lub masy) roztworu.
Stężenie procentowe Cp wyraża liczbę gramów substancji rozpuszczonej,znajdującej się w 100 gramach roztworu: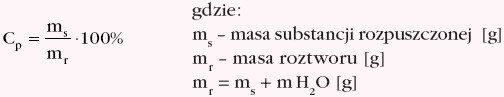
Stężenie molowe Cm określa liczbę moli substancji rozpuszczonej w 1 dm3 (1000 cm3) roztworu:
Przy wzajemnym przeliczaniu stężeń można korzystać ze wzoru:
Aby przygotować roztwór o określonym stężeniu należy:
- obliczyć liczbę gramów substancji rozpuszczanej potrzebną do sporządzenia roztworu, a następnie odważyć tę ilość substancji,
- do kolby miarowej wlać niewielką ilość rozpuszczalnika, a następnie wsypać odważoną ilość substancji rozpuszczanej,
- po rozpuszczeniu substancji dopełnić kolbę rozpuszczalnikiem do określonej objętości i roztwór wymieszać.
Rozcieńczone roztwory substancji nielotnych wrą w temperaturze wyższej od temperatury wrzenia czystego rozpuszczalnika, a krzepną w temperaturze niższej od temperatury krzepnięcia czystego rozpuszczalnika. Podwyższenie (obniżenie) temperatury jest tym większe, im większe jest stężenie wszystkich form (cząsteczek, jonów) substancji rozpuszczonej w roztworze. Te właściwości zaliczamy do tzw. koligatywnych właściwości roztworów.
Ciśnienie osmotyczne należy również do właściwości koligatywnych i jest związane z procesem osmozy, czyli samorzutnego przechodzenia cząsteczek rozpuszczalnika przez błonę półprzepuszczalną z roztworu o niższym stężeniu do roztworu o wyższym stężeniu. Przez błonę półprzepuszczalną mogą przenikać cząsteczki rozpuszczalnika, a nie cząsteczki substancji rozpuszczonej.

