Substancje stałe, ciekłe lub gazowe posiadają różną zdolność do tworzenia z innymi substancjami układów homogenicznych.
Rozpuszczanie to fizyczny proces mieszania się dwóch substancji, prowadzący do otrzymania roztworu:
- rozpuszczanie cieczy w cieczy ⇒ aby szybko i równomiernie wymieszać dwie ciecze, należy ciecz o większej gęstości wlać do cieczy o mniejszej gęstości,
- rozpuszczanie gazu w cieczy ⇒ w tym przypadku należy pamiętać o różnicy w sposobach wprowadzania do naczynia gazów dobrze rozpuszczalnych i gazów o niewielkiej rozpuszczalności w tej cieczy,
- rozpuszczanie ciała stałego w cieczy ⇒ kolejność wprowadzania składników jest dowolna, ale lepiej jest wlać ciecz do naczynia, w którym jest już ciało stałe rozpuszczone częściowo w niewielkiej ilości cieczy.
Rozpuszczalność zależy od:
- rodzaju substancji rozpuszczonej,
- rodzaju rozpuszczalnika,
- temperatury (rozpuszczalność większości ciał stałych i cieczy rośnie ze wzrostem temperatury, a rozpuszczalność gazów maleje),
- dla gazów: od ciśnienia (rozpuszczalność gazów rośnie ze wzrostem ciśnienia),
- stanu rozdrobnienia substancji stałej,
- bodźców mechanicznych (mieszanie): przy rozpuszczaniu ciała stałego w cieczy mieszanie ułatwia rozpuszczanie; natomiast wstrząsy obniżające rozpuszczalność gazu w cieczy ułatwiają jego wydzielanie z roztworu.
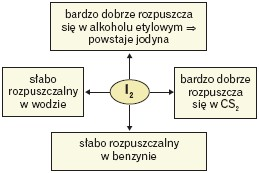 Rozpuszczalność jest cechą danej pary substancji: substancja rozpuszczana + rozpuszczalnik w określonej temperaturze.Tę cechę można prześledzić na przykładzie jodu i jego rozpuszczalności w wybranych rozpuszczalnikach:
Rozpuszczalność jest cechą danej pary substancji: substancja rozpuszczana + rozpuszczalnik w określonej temperaturze.Tę cechę można prześledzić na przykładzie jodu i jego rozpuszczalności w wybranych rozpuszczalnikach:
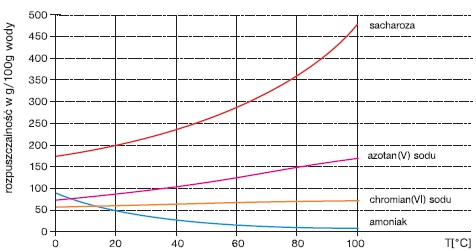
Na ogół ilość substancji, którą można rozpuścić w danej ilości rozpuszczalnika w określonej temperaturze, jest ograniczona i prowadzi do uzyskania tzw. roztworu nasyconego. Ilość substancji niezbędnej do uzyskania roztworu nasyconego określa wielkość fizyczna zwana rozpuszczalnością. Rozpuszczalność to liczba gramów danej substancji niezbędna do nasycenia 100 g rozpuszczalnika w danej temperaturze. Krzywe rozpuszczalności przedstawiają zmiany rozpuszczalności wraz z temperaturą, np.:
 Efekty towarzyszące procesowi rozpuszczania, np. zmiana temperatury, zmiana objętości (zjawisko kontrakcji lub dylatacji), solwatacja (otaczanie cząsteczek lub jonów substancji rozpuszczonej przez cząsteczki rozpuszczalnika; solwatacja w roztworach wodnych to hydratacja).
Efekty towarzyszące procesowi rozpuszczania, np. zmiana temperatury, zmiana objętości (zjawisko kontrakcji lub dylatacji), solwatacja (otaczanie cząsteczek lub jonów substancji rozpuszczonej przez cząsteczki rozpuszczalnika; solwatacja w roztworach wodnych to hydratacja).
Proces rozpuszczania substancji krystalicznej w ciekłym rozpuszczalniku przebiega w kilku etapach:
| etapy procesu rozpuszczania | charakterystyka energetyczna etapów procesu rozpuszczania | typ etapu: egzoenergetyczny lub endoenergetyczny |
| - niszczenie sieci krystalicznej substancji (odrywanie jonów z powierzchni kryształu) | - energia E1 potrzebna do zniszczenia sieci krystalicznej substancji rozpuszczonej jest przekazana z otoczenia do układu | - proces endoenergetyczny |
| - niszczenie oddziaływań międzycząsteczkowych w rozpuszczalniku | - energia E2 potrzebna do zniszczenia oddziaływań między cząsteczkowych w rozpuszczalniku jest przekazana z otoczenia do układu | - proces endoenergetyczny |
| - powstanie oddziaływań między jonami substancji rozpuszczonej a cząsteczkami rozpuszczalnika | - energia hydratacji E3 jonów substancji rozpuszczonej jest uwalniana w trakcie procesu z układu do otoczenia | - proces egzoenergetyczny |
Rozpuszczanie, np. stałego NaOH w wodzie, jest procesem, któremu towarzyszy podwyższenie temperatury układu, gdyż: (E1 + E2) < E3; rozpuszczanie stałego NH4NO3 w wodzie jest procesem, któremu towarzyszy obniżenie temperatury układu, gdyż: (E1 + E2) > E3.
Procesem odwrotnym do rozpuszczania jest krystalizacja. Krystalizacja polega na wydzielaniu z roztworu substancji rozpuszczonej w formie krystalicznej. Krystalizacja może zachodzić w wyniku odparowywania rozpuszczalnika. Zmniejszająca się ilość rozpuszczalnika powoduje wzrost stężenia substancji rozpuszczonej w roztworze, co sprzyja agregacji cząsteczek substancji rozpuszczonej i tworzeniu zarodków krystalizacji. Zarodki krystalizacji to skupiska cząsteczek substancji rozpuszczonej mające uporządkowaną strukturę przypominającą strukturę kryształu. Wprowadzenie do roztworu zarodków krystalizacji np. małego kryształu (fragmentu sieci krystalicznej) powoduje przyspieszenie krystalizacji.
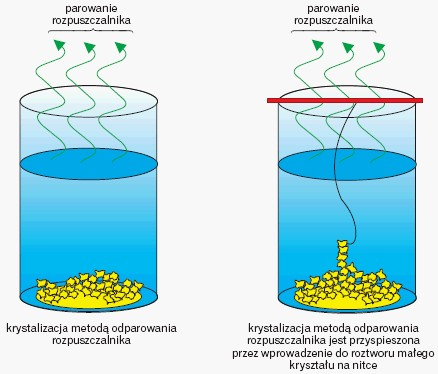
Rozpoczęciu procesu krystalizacji sprzyja zwykle obniżanie temperatury układu. Spadek temperatury powoduje obniżenie rozpuszczalności substancji rozpuszczonej i wydzielanie się jej nadmiaru z roztworu w postaci kryształów.

