Wiązanie kowalencyjne (atomowe) polega na uwspólnieniu pary lub par elektronowych. Uwspólniona para lub pary elektronowe znajdują się między rdzeniami atomów. Przyjęto umownie, że wiązanie kowalencyjne tworzy się, gdy różnica elektroujemności atomów pierwiastków (ΔE) tworzących to wiązanie jest niewielka lub równa zero (ΔE < 0,4).
Jeżeli uwspólniono jedną parę elektronową, to wiązanie nazywamy pojedynczym,jeżeli uwspólniono dwie pary elektronowe – podwójnym, trzy – potrójnym, np.:
 |
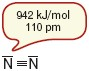 |
| jedna wspólna para elektronowa, wiązanie pojedyncze |
trzy wspólne pary elektronowe, wiązanie potrójne |
Analizując powyższe dane można stwierdzić, że im bardziej krotne jest wiązanie, tym jest krótsze, a jego energia wzrasta.
Wiązanie kowalencyjne może być spolaryzowane. Polaryzacja wiązania polega na przesunięciu wspólnej pary elektronowej w kierunku atomu o większej elektroujemności. Konsekwencją tego jest rozdzielenie ładunku wewnątrz cząsteczki – atom bardziej elektroujemny zyskuje cząstkowy ładunek ujemny (δ–), a atom mniej elektroujemny cząstkowy ładunek dodatni (δ+).
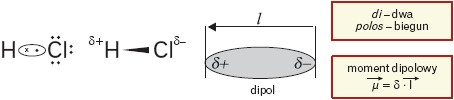
Cząsteczka HCl jest więc dipolem. Dipol to układ dwóch ładunków elektrycznych δo jednakowej wartości, lecz przeciwnych znakach, położonych w niewielkiej odległości l od siebie.
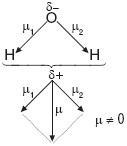
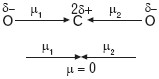
Polaryzację wiązania można określić, podając moment dipolowy wiązania. Zgodnie z umową jest to wektor o zwrocie od bieguna ujemnego do bieguna dodatniego dipola. Jeżeli w cząsteczce występuje kilka wiązań spolaryzowanych, to można (w pewnym uproszczeniu) przyjąć, że moment dipolowy cząsteczki jest sumą wektorową momentów dipolowych poszczególnych wiązań. W zależności od rzeczywistego kształtu cząsteczki jej moment dipolowy może być równy zero (budowa liniowa, istnieją elementy symetrii, symetryczny rozkład ładunków) albo różny od zera (niesymetryczny rozkład ładunków, zazwyczaj budowa nieliniowa).
 |
 |
| Cząsteczka wody ma budowę kątową (niesymetryczny rozkład ładunków – cząsteczka jest dipolem) |
Cząsteczka CO2 ma budowę liniową (symetryczny rozkład ładunków – cząsteczka nie jest dipolem) |
Umownie przyjęto, że wiązanie kowalencyjne spolaryzowane tworzy się pomiędzy atomami pierwiastków, dla których różnica elektroujemności ΔE przyjmuje wartości0,4 ΔE < 1,7.

