Cząsteczki alkanów zbudowane są z atomów węgla, których orbitale walencyjne są w stanie hybrydyzacji sp3. Atomy węgla połączone są ze sobą wyłącznie wiązaniami pojedynczymi σ. Długość wiązania pojedynczego węgiel-węgiel wynosi 154 pm, a energia wiązania 368 kJ/mol. Cząsteczki alkanów nie są płaskie, a możliwość obrotu atomów lub grup atomów połączonych z sąsiednimi atomami węgla wokół wiązania σ powoduje, że istnieją różnorodne orientacje w przestrzeni określane mianem konformacji cząsteczki (dotyczy to stanu gazowego i ciekłego).
Alkany tworzą szereg homologiczny o wzorze ogólnym: CnH2n+2 (gdzie n oznacza liczbę atomów węgla w cząsteczce). Poszczególne człony szeregu zwane homologami, różnią się o taki sam element strukturalny (-CH2-) lub jego krotność. Homologi wykazują podobne właściwości chemiczne (szereg alkanów), a właściwości fizyczne stopniowo zmieniają się ze wzrostem długości łańcucha węglowego.
W szeregu homologicznym alkanów wraz ze wzrostem liczby atomów węgla w łańcuchu węglowym:
- zmienia się stan skupienia,
- rosną temperatury topnienia i wrzenia,
- wzrasta gęstość.
Wiązanie węgiel-wodór jest praktycznie niespolaryzowane (ΔE = 0,4), zatem cząsteczki alkanów są na ogół niepolarne. Te niepolarne cząsteczki nie mogą utworzyć z cząsteczkami wody wiązań wodorowych, co jest warunkiem rozpuszczalności w wodzie. Alkany są praktycznie nierozpuszczalne w wodzie, a rozpuszczają się w rozpuszczalnikach organicznych.
Poniżej podano wzory i nazwy wybranych 3 węglowodorów oraz grup alkilowych R–
CH4 metan – CH3 metyl (grupa metylowa)
C2H6 etan – C2H5 etyl (grupa etylowa)
C3H8 propan – C3H7 propyl (grupa propylowa)
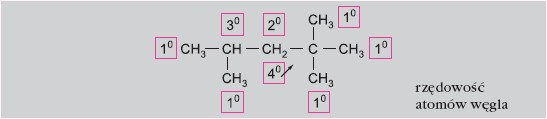
Wiązania węgiel-węgiel i węgiel-wodór typu σ należą do mocnych (duża energia wiązania), trudnych do rozerwania i dlatego alkany charakteryzuje raczej bierność chemiczna. Podwyższona temperatura i promieniowanie powodują wzrost aktywności alkanów.
Reakcją wspólną dla wszystkich alkanów jest reakcja spalania, której najszybciej ulegają w podwyższonej temperaturze alkany gazowe. Spalanie może być całkowite lub niecałkowite:
- spalanie całkowite etanu: 2 C2H6 + 7 O2 → 4 CO2 + 6 H2O
- spalanie niecałkowite etanu: 2 C2H6 + 5 O2 → 4 CO + 6 H2O lub 2 C2H6 + 3 O2 → 4 C + 6 H2O
Charakterystyczną cechą węglowodorów nasyconych jest zdolność do reakcji substytucji, czyli podstawiania. Substytucja zachodzi, gdy dwa substraty wymieniają się fragmentami swoich cząsteczek, tworząc dwa nowe produkty.
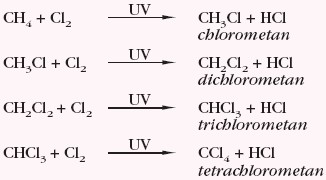
Alkany ulegają halogenowaniu (reagują z X2, gdzie X2 = Br2, Cl2) podczas naświetlania lub ogrzewania, co można przedstawić poniższymi równaniami reakcji dla wybranego alkanu:
Podczas monochlorowania propanu w warunkach podanych powyżej powstają różne produkty, gdyż w jego cząsteczce nie wszystkie atomy wodoru są równocenne.
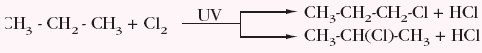
Zatem substrat został przekształcony w dwa produkty powstające w wyniku przebiegu tzw. reakcji równoległych, czyli konkurencyjnych. Jedna z nich jest dominująca i nosi nazwę reakcji głównej, pozostała to reakcja uboczna. W przypadku propanu produktem głównym jest 2-chloropropan.
