Tlen należy do najbardziej rozpowszechnionych pierwiastków na Ziemi. Występuje w stanie wolnym w powietrzu, a w stanie związanym– w hydrosferze, licznych minerałach i organizmach żywych.
Tlen należy do najbardziej rozpowszechnionych pierwiastków na Ziemi. Występuje w stanie wolnym w powietrzu, a w stanie związanym– w hydrosferze, licznych minerałach i organizmach żywych.
Konfiguracja elektronowa atomu tlenu: 1s2 2s2 2p4.
Stopnie utlenienia tlenu w związkach: –II, –I, –1/2, II.
Tlen jest bezwonnym, bezbarwnym gazem, bardzo słabo rozpuszczalnym w wodzie, podtrzymującym palenie. Należy do bardzo reaktywnych pierwiastków – reaguje bezpośrednio prawie ze wszystkimi pierwiastkami. Produktem tych reakcji są tlenki, ale w określonych warunkach i dla określonych pierwiastków mogą tworzyć się nadtlenki i ponad tlenki.
Otrzymywanie:
- w laboratorium – termiczny rozkład różnych związków, np.
2 KMnO4 → O2 + K2MnO4 + MnO2
2 KClO3 → 2 KCl + 3 O2
Do celów specjalnych można tlen otrzymać w wyniku elektrolizy wody. - w przemyśle – frakcjonowana destylacja skroplonego powietrza.
Tlen występuje w dwóch odmianach alotropowych:
- O2 – cząsteczka dwuatomowa
- O3 – cząsteczka trzy atomowa (ozon)
Ozon jest gazem o specyficznym, ostrym zapachu. Występuje głównie w górnych warstwach atmosfery tworząc warstwę zwaną ozonosferą.
Ozon jest substancją nietrwałą i rozkładając się wydziela tlen. Poniżej podano uproszczony zapis ciągu reakcji: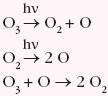
Ten fakt ściśle wiąże się z jego właściwościami utleniającymi i bakteriobójczymi.
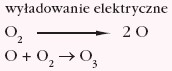
Podczas wyładowań atmosferycznych cząsteczka tlenu O2 rozpada się na bardzo aktywne atomy tlenu: