 Azot jest pierwiastkiem, który w stanie wolnym stanowi główny składnik atmosfery ziemskiej, a w formie związanej występuje w postaci licznych minerałów (np. NaNO3 – saletra chilijska,KNO3 – saletra indyjska). Występuje też w organizmach żywych, będąc głównym składnikiem białka zwierzęcego i roślinnego.
Azot jest pierwiastkiem, który w stanie wolnym stanowi główny składnik atmosfery ziemskiej, a w formie związanej występuje w postaci licznych minerałów (np. NaNO3 – saletra chilijska,KNO3 – saletra indyjska). Występuje też w organizmach żywych, będąc głównym składnikiem białka zwierzęcego i roślinnego.
Konfiguracja elektronowa atomu azotu: 1s22s22p3.
Stopnie utlenienia azotu w związkach: –III, I, II, III, IV, V.
Otrzymywanie:
- na skalę przemysłową – frakcjonowana destylacja skroplonego powietrza
- na skalę laboratoryjną – np. rozkład azotanu(III) amonu:
NH4NO2 → N2 + 2 H2O
Azot jest bezbarwnym, bezwonnym gazem. Jest nieco lżejszy od powietrza, słabo rozpuszcza się w wodzie. W temperaturze pokojowej jest bardzo mało reaktywny. Reaktywność azotu można zwiększyć ogrzewając go lub poddając wyładowaniom elektrycznym w warunkach niskiego ciśnienia.
Amoniak jest lekkim, bezbarwnym gazem o charakterystycznym zapachu, drażniącym błony śluzowe. W wodzie rozpuszcza się bardzo dobrze, a powstały roztwór ma odczyn zasadowy.![]()
Amoniak można otrzymać działając mocną zasadą na sole amonowe w podwyższonej temperaturze:
NH4Cl + KOH → KCl + NH3↑ + H2O
Reakcja ta służy do wykrycia jonów NH4+ w roztworze wodnym. Nietrwałość soli amonowych wykorzystuje się np. w proszku dopieczenia, którego składnikiem jest wodorowęglan amonu:![]()
Amoniak reaguje z chlorowodorem tworząc białe dymy chlorku amonu:
NH3 + HCl → NH4Cl
Amoniak spala się w tlenie tworząc azot i wodę:
4 NH3 + 3 O2 → 2 N2 + 6 H2O
W obecności katalizatora produktem spalania amoniaku w tlenie jest tlenek azotu(II):![]()
Azot tworzy z tlenem liczne związki: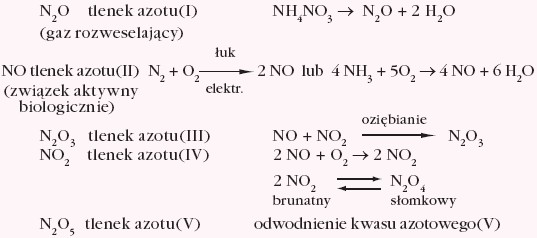
Spośród kwasów tlenowych azotu na uwagę zasługuje:
- kwas azotowy(III) – nietrwały związek, łatwo ulega rozkładowi:
3 HNO2 → HNO3 + 2 NO + H2O - kwas azotowy(V) – bezbarwna ciecz ulegająca powolnemu rozkładowi:
4 HNO3 → 4 NO2 + 2 H2O + O2
Roztwory kwasu azotowego(V) mają żółte zabarwienie wskutek obecności tlenku azotu(IV).
Rozcieńczony, jak i stężony kwas azotowy(V) należy do kwasów silnie utleniających – reaguje zarówno z metalami, jak i niemetalami:
3 Cu + 8 HNO3 rozc. → 3 Cu(NO3)2 + 2 NO + 4 H2O
Cu + 4 HNO3 stęż. → Cu(NO3)2 + 2 NO2 + 2 H2O
P4 + 20 HNO3stęż. → 4 H3PO4 + 20 NO2 + 4 H2O
Niektóre metale, np. glin, żelazo, pod wpływem stężonego HNO3 ulegają pasywacji.
Stężony kwas azotowy(V) niszczy barwniki, papier. Substancje białkowe pod wpływem jego działania przyjmują charakterystyczną żółtą barwę (reakcja ksantoproteinowa).

