Atom zbudowany jest z dodatnio naładowanego jądra i zajmujących przestrzeń poza jądrem elektronów. Jądro składa się z protonów i neutronów, czyli nukleonów.
| Proton p | Neutron n | Elektron e |
|
|
|
Liczba atomowa Z określa liczbę protonów w jądrze atomu. Ponieważ atom to układ elektrycznie obojętny, liczba ta określa również liczbę elektronów.
Liczba masowa A określa sumę protonów i neutronów w jądrze atomu.
Pierwiastek to zbiór atomów o tej samej liczbie atomowej Z.
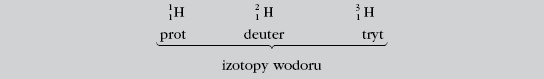
Jądra atomów o jednakowej liczbie atomowej Z, a różnej liczbie masowej A to izotopy. Atomy należące do jednego izotopu danego pierwiastka to nuklidy (mają taką samą liczbę atomową Z i masową A).
Jądra atomów o różnej liczbie atomowej Z, a jednakowej liczbie masowej A to izobary.![]()
Jądra atomów o różnej liczbie atomowej Z, a jednakowej liczbie neutronów to izotony.![]()
Atomowa jednostka masy to międzynarodowa jednostka masy atomowej równa 1/12 masy atomu węgla 12C:
1 u = 1,66 · 10–27 kg
Masa atomowa to masa pojedynczego atomu wyrażona w atomowych jednostkach masy u.
Masa cząsteczkowa to masa pojedynczej cząsteczki wyrażona w atomowych jednostkach masy u. Stanowi sumę mas atomowych wszystkich atomów wchodzących w skład cząsteczki. Masa atomowa pierwiastka jest średnią ważoną mas atomowych izotopów, wynikającą z procentowej zawartości poszczególnych izotopów w naturalnej mieszaninie:
![]()
A1, A2, ... – liczby masowe poszczególnych izotopów
p1, p2, ... – procentowe zawartości poszczególnych izotopów
Zachowania mikrocząstek (np. elektronów) nie można opisać w oparciu o klasyczną mechanikę Newtona. W opisie zachowania elektronów obowiązują zasady mechaniki kwantowej, której podstawę stanowi przyjęcie korpuskularno-falowej natury elektronu (dualizm) oraz zasada nieoznaczoności Heisenberga. Zgodnie z postulatem de Broglie’a każdej cząstce (np. elektronowi) o określonej masie i pędzie odpowiada fala o określonej długości. Zasada nieoznaczoności Heisenberga zakłada, że nie jest możliwe równoczesne dokładne określenie położenia i pędu elektronu w określonym stanie. Im dokładniej oznaczymy położenie, tym mniej dokładnie określimy pęd. W przypadku położenia możemy mówić o prawdopodobieństwie przebywania (napotkania) elektronu w określonym elemencie przestrzeni (objętości atomu). Rozkład gęstości tego prawdopodobieństwa otrzymuje się rozwiązując obowiązujące w mechanice kwantowej równanie Schrődingera.
Orbital atomowy jest falową funkcją położenia elektronu zależną od współrzędnych x, y, z. Kwadrat bezwzględnej wartości tej funkcji falowej określa gęstość prawdopodobieństwa. Postać tych funkcji (np. kształt, rozmiar) opisana jest zestawem trzech liczb kwantowych (głównej, orbitalnej, magnetycznej).
Stan elektronu w atomie opisuje zestaw pięciu liczb kwantowych, których charakterystykę przedstawiono w poniższej tabeli:
| Nazwa, symbol, możliwe wartości i liczba możliwych wartości liczby kwantowej | Charakterystyka | Wielkość kwantowana (wielkość fizyczna) |
| główna liczba kwantowa n = 1, 2, 3, … |
określa całkowitą energię elektronu, liczbę powłok i decyduje o rozmiarach konturu orbitalu | energia elektronu |
| orbitalna (poboczna) liczba kwantowa l = 0, …, (n–1) liczba możliwych wartości: n |
określa liczbę podpowłok w powłoce i decyduje o kształcie konturu orbitalu | orbitalny moment pędu elektronu |
| magnetyczna liczba kwantowa m = –l, …, 0, … +l liczba możliwych wartości: 2l+1 |
określa liczbę poziomów orbitalnych w danej podpowłoce i decyduje o orientacji przestrzennej konturu orbitalu | składowa z orbitalnego momentu pędu elektronu |
| spinowa liczba kwantowa s = 1/2 |
spinowy moment pędu elektronu | |
| magnetyczna spinowa liczba kwantowa ms = 1/2 lub –1/2 |
składowa z spinowego momentu pędu elektronu |
Powłoką nazywamy zbiór wszystkich stanów kwantowych określonych daną wartością głównej liczby kwantowej. Poszczególnym wartościom głównej liczby kwantowej przyporządkowuje się symbole kolejnych powłok, np. n = 1 ⇒ powłoka K, n = 2 ⇒powłoka L, n = 3 ⇒ powłoka M, itd.
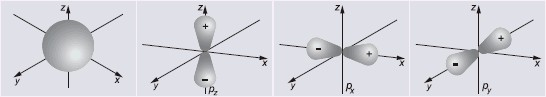
Typ orbitalu jest zdeterminowany przez jego kontur, którego kształt określa przestrzeń, poza którą prawdopodobieństwo napotkania elektronu w atomie jest zaniedbywalnie małe. W zależności od wartości orbitalnej liczby kwantowej wyróżniamy orbitale s, p, d i f:
- l = 0 orbital s (podpowłoka s)
- l = 1 orbital p (podpowłoka p)
- l = 2 orbital d (podpowłoka d)
- l = 3 orbital f (podpowłoka f)
W obrębie powłoki wyróżniamy podpowłoki określone przez wartość orbitalnej liczby kwantowej, co przedstawiono powyżej.
Jak wynika z zależności między liczbami kwantowymi, istnieje zawsze jeden orbital s, trzy orbitale p, pięć orbitali d oraz siedem orbitali f. Np. orbitale p – px, py, pz różnią się przestrzennym rozmieszczeniem konturów i stanowią przykład orbitali zdegenerowanych. Orbital danego typu jest m-krotnie zdegenerowany.

Poniżej przedstawiono kontury orbitali atomowych s i p.