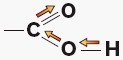
Wskutek polaryzacji wiązania w grupie karbonylowej osłabieniu ulega wiązanie tlen-wodór w grupie hydroksylowej, co ułatwia oderwanie jonu H+.
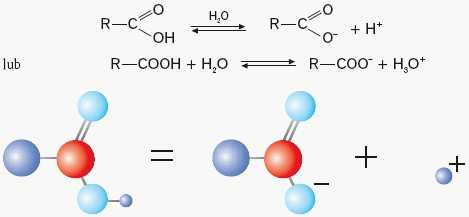
Rozpuszczalne w wodzie kwasy ulegają dysocjacji elektrolitycznej z odszczepieniem kationów H+, co przedstawiono poniższymi równaniami:
Kwasy karboksylowe należą do elektrolitów słabych; ze wzrostem długości łańcucha węglowego w cząsteczce kwasu maleje ich moc.
| wzór kwasu | stała(e) dysocjacji kwasu |
| kwasy monokarboksylowe | |
| HCOOH | Ka = 1,84 ·10–4 |
| CH3COOH | Ka = 1,75 ·10–5 |
| CH3CH2COOH | Ka = 1,34 ·10–5 |
| CH3CH2CH2COOH | Ka = 1,53 ·10–5 |
| kwasy polikarboksylowe | |
| HOOC–COOH | Ka1 = 5,60 · 10–2 Ka2 = 5,42 · 10–5 |
| kwasy aromatyczne | |
| kwas benzoesowy | Ka = 6,27 · 10-5 |
Miarą mocy kwasu jest STAŁA DYSOCJACJI
Na podstawie wartości stałych dysocjacji można stwierdzić, że:
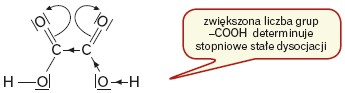
- moc kwasu wzrasta w miarę wzrostu liczby grup karboksylowych w cząsteczce,
- moc kwasu maleje w miarę wzrostu długości łańcucha węglowego,
- moc kwasu maleje w miarę wzrostu stopnia nasycenia fragmentu węglowodorowego,
- moc kwasu maleje wraz ze wzrostem długości łańcucha węglowego, oddzielającego grupy karboksylowe (dla kwasów polikarboksylowych),
- kwas benzoesowy jest kwasem mocniejszym od octowego, ale słabszym od mrówkowego.
W przypadku obecności w cząsteczce kwasu wielu grup karboksylowych, zwiększenie jego mocy wynika z efektu indukcyjnego w jednej grupie karboksylowej, ułatwiającego oderwanie jonu H+ z drugiej grupy: