Energię aktywacji można zdefiniować jako najmniejszą wartość energii, jaką muszą posiadać cząstki (drobiny) substratów, aby zapoczątkować reakcję między nimi.
Proces przekształcania się substratów w produkty reakcji przebiega zwykle przez etapy pośrednie, które mogą obejmować zderzenia pomiędzy cząsteczkami substratów lub wytwarzanie stanów przejściowych w postaci nietrwałych kompleksów atomów. Obdarzone odpowiednią energią kinetyczną substraty znajdujące się w fazie gazowej mogą zderzać się ze sobą. W wyniku zderzeń następuje przegrupowanie elektronów, utworzenie nowych wiązań chemicznych i powstawanie cząsteczek produktów. Efektywne są tylko te zderzenia, w których biorą udział substraty obdarzone odpowiednią energią – czyli energią aktywacji. Jest to tzw.teoria zderzeń aktywnych.
Według innej teorii, zwanej teorią kompleksu aktywnego (lub stanu przejściowego), zderzające się ze sobą substraty, obdarzone odpowiednią energią (energią aktywacji) tworzą nietrwałe kompleksy, czyli zespoły atomów, które mogą się rozpaść wytwarzając produkty lub substraty.
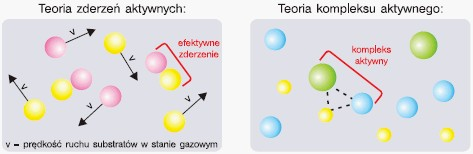
| definicje energii aktywacji w teorii zderzeń aktywnych i w teorii kompleksu aktywnego | |
| W teorii zderzeń aktywnych energię aktywacji definiuje się jako minimalną energię, jaką muszą posiadać cząstki (drobiny) reagentów, aby ich zderzenie było efektywne, niezbędne do zapoczątkowania reakcji. Jakie zderzenia są efektywne? Cząsteczki muszą być względem siebie odpowiednio zorientowane w momencie zderzenia (czynnik steryczny) oraz muszą posiadać minimalną progową wartość energii (czyli energię aktywacji). | W teorii kompleksu aktywnego energia aktywacji jest minimalną energią niezbędną do utworzenia kompleksu aktywnego. |
Zależność temperaturową szybkości reakcji przebiegającej w dwóch różnych temperaturach określa w przybliżeniu reguła van’t Hoffa: przy wzroście temperatury o 10 stopni K (lub 10° C)szybkość reakcji rośnie od 2 do 4 razy:
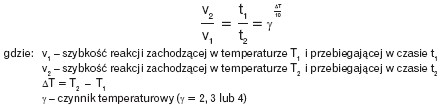
Szybkość reakcji zależy też od innych czynników:
- rodzaju rozpuszczalnika – szczególnie istotne w reakcjach pomiędzy związkami organicznymi,
- promieniowania elektromagnetycznego – reakcje fotochemiczne,
- rozdrobnienia i mieszania reagentów,
- ciśnienia – w przypadku reakcji przebiegającej z udziałem reagentów gazowych szybkość reakcji rośnie ze wzrostem ciśnienia,
- obecności katalizatora.

