Hybrydyzacja to zabieg matematyczny polegający na kombinacji liniowej walencyjnych orbitali atomowych tego samego atomu. Otrzymane zhybrydyzowane orbitale są mieszaninami (hybrydami) orbitali wyjściowych i charakteryzują się jednakowym kształtem konturu i energią (co odróżnia je od orbitali, z których powstały). Typ hybrydyzacji określa, które walencyjne orbitale atomowe zostały poddane matematycznemu przekształceniu, a jednocześnie wyznacza rozmieszczenie przestrzenne powstałych hybryd. Hybrydy w przestrzeni ułożone są w sposób gwarantujący ich minimalne oddziaływania.
Krótka charakterystyka typów hybrydyzacji:
| typ hybrydyzacji | liczba i ułożenie hybryd | nazwa hybrydyzacji |
| sp | dwie hybrydy ułożone liniowo | hybrydyzacja dygonalna |
| sp2 | trzy hybrydy skierowane do naroży trójkąta równobocznego, leżące w jednej płaszczyźnie | hybrydyzacja trygonalna |
| sp3 | cztery hybrydy skierowane do naroży tetraedru | hybrydyzacja tetragonalna |
Przestrzenny układ hybryd danego typu:
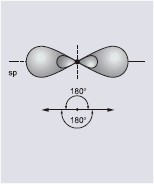 |
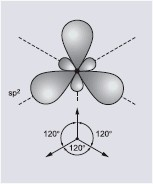 |
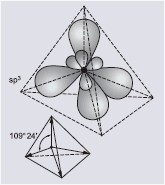 |
| Hybrydyzacja sp | Hybrydyzacja sp2 | Hybrydyzacja sp3 |

